备受瞩目的美国糖尿病协会第85届科学会议(ADA)于2025年6月20日至23日在美国芝加哥盛大召开。在这个全球规模最大、最具影响力的糖尿病学术会议上,众生睿创受邀以壁报形式展示自主研发的超长效GLP-1/GIP激动剂RAY1225注射液两周一次治疗超重/肥胖参与者和2型糖尿病病参考者Ⅱ期临床试验的最新结果。并与文献报道的同靶点药物替尔泊肽国内相应人群Ⅲ期临床的有效性和安全性进行了比较,相关内容如下:
报告人纪立农在壁报中指出,RAY1225每两周一次治疗中国肥胖或超重成人参与者的疗效和安全性。
研究概要表明,RAY1225注射液每两周1次给药治疗超重或肥胖参与者起效快,疗效强,安全性良好。治疗10周后RAY1225各组平均体重降幅均超过10%,治疗24周9mg组下降超过15%。治疗24周时体重下降≥5%的参与者比例高达95.1%。在安全性方面也展现出了独特的优势,未发现新的安全性风险。
从试验设计层面来看,REBUILDING-1研究采用剂量递增试验与扩展试验联合,交错启动剂量组的试验设计,包括RAY1225注射液3mg、6mg、安慰剂对照平行研究,和9mg及以上的剂量递增及扩展的安慰剂组内对照研究两部分,入组18岁及以上的超重或肥胖参与者。所有参与者均以滴定给药的方式接受24周皮下注射给药,每两周给药1次,共连续给药12次。此次大会中公布了3~9mg组有效性和安全性的阶段性结果,更高剂量组试验仍在进行中。
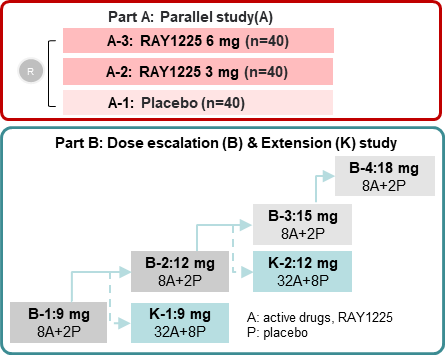
图1:RBUILDING-1研究设计
基线人口统计学特征如下
表1:RBUILDING-1研究基线人口统计学特征
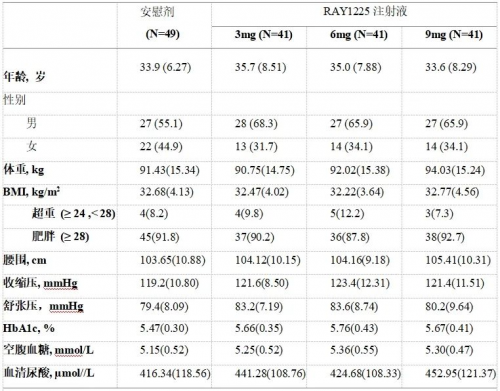
结果以均值(标准差)呈现。
每组人口统计学特征相似。
从安全性这一角度而言,一方面其耐受性良好,RAY1225注射液在3~9mg剂量范围内,所有剂量组均表现出良好的耐受性,未发现新增安全性信号,整体安全性特征与既往临床试验和GLP-1类药物类似,相对缓慢的滴定过程让患者在治疗过程中能够更加舒适地接受药物治疗。
另一方面,胃肠道反应轻。胃肠道不良反应是GLP-1类药物最常见的不良反应之一。在REBUILDING-1研究中,RAY1225注射液引起的胃肠道不良反应严重程度大多较轻微,多发生在剂量滴定阶段,胃肠道不良反应的发生率低于同靶点药物替尔泊肽在中国超重或肥胖人群的Ⅲ期研究(SURMOUNT-CN)中的报道数据[1]。其中,9mg组的腹泻、恶心、呕吐的发生率较替尔泊肽15mg组分别低11.5%、27.5%和9.9%,无患者因胃肠道不良反应停用药物。
表2:REBUILDING-1研究与SURMOUNT-CN安全性比较(n,%)
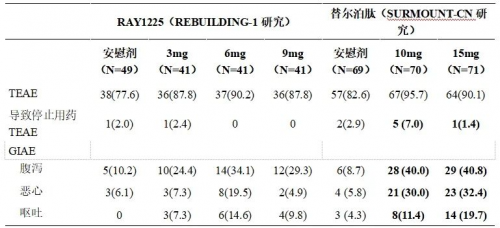
TEAE:治疗期间不良事件;GIAE:胃肠道不良事件
从有效性结果来看,减重效果良好, RAY1225注射液3mg~9mg组每两周1次给药,治疗24周后体重降幅可达10.05%~15.05%。在减重达标率方面,3mg、6mg和9mg组体重较基线变化百分比≥5%的受试者比例分别为73.2%、95.1%和95.1%;各组减重效应均优于安慰剂组。RAY1225在更低剂量下就实现了与替尔泊肽相近甚至更优的减重效果[1],展现了其在减重治疗方面的潜力和优势。
心血管代谢生物标记物方面,RBUILDING-1研究设计RAY1225在心血管和代谢相关指标(腰围、血压、血脂、血尿酸和肝酶、肝脏脂肪含量、空腹血糖和糖化血红蛋白等)中均展现出显著综合优势。能够更全面地改善患者的代谢状况,为患者带来更广泛的健康益处。
图2 体重较基线变化(mFAS,LSmean)
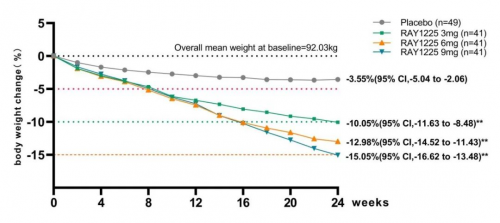
图3 治疗24周减重达标率(mFAS,LSmean)
此外,报告人李海军在研究概要中指出,研究采用剂量递增试验与扩展试验联合,交错启动剂量组的试验设计,包括RAY1225注射液3mg、6mg、安慰剂对照平行研究,和9mg及以上的剂量递增及扩展的安慰剂组内对照研究两部分,入组18岁及以上的2型糖尿病患者。所有参与者均以滴定给药的方式接受24周皮下注射给药,每两周给药1次,共连续给药12次。此次大会中公布了3~9mg组有效性和安全性的阶段性结果,更高剂量组的试验仍在进行。
研究设计如下
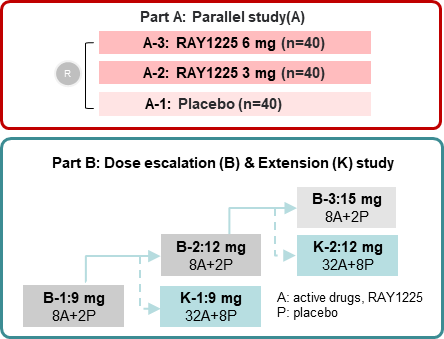
图4:SHINING-1研究设计
基线人口统计学特征如下
表3:SHINING-1研究基线人口统计特征
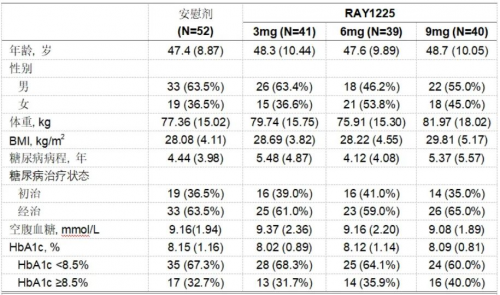
结果以均值(标准差)呈现。
每组人口统计学特征相似。
安全性方面,一方面耐受性良好,RAY1225 注射液在 3~9mg 剂量范围内,所有剂量组均表现出良好的耐受性,未发现新增安全性信号,整体安全性特征与既往临床试验和 GLP-1 类药物类似,相对缓慢的滴定过程让患者在治疗过程中能够更加舒适地接受药物治疗。
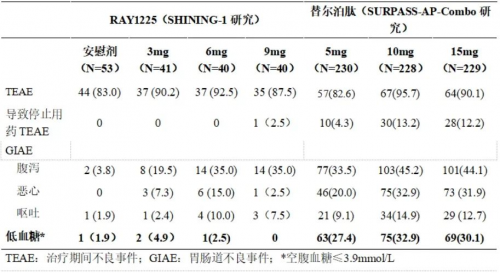
另一方面,胃肠道反应轻。胃肠道不良反应是 GLP-1 类药物最常见的不良反应之一。在SHINING-1研究中,RAY1225 注射液引起的胃肠道不良反应严重程度大多较轻微,多发生在剂量滴定阶段。胃肠道不良反应的发生率低于同靶点药物替尔泊肽在以中国2型糖尿病人群为主的SURPASS-AP-Combo Ⅲ期研究中的报道数据[2]。其中,9mg组的腹泻、恶心、呕吐的发生率较替尔泊肽15mg组分别低9.1%、29.4%和5.2%,无患者因胃肠道不良反应停用药物。
更为重要的是,低血糖风险低。RAY1225 注射液的低血糖风险较低,未发生严重低血糖事件。患者在使用过程中不必过度担心低血糖的发生,能够更安心地进行降糖治疗。
表4:SHINING-1研究与SURPASS-AP-Combo安全性比较(n,%)
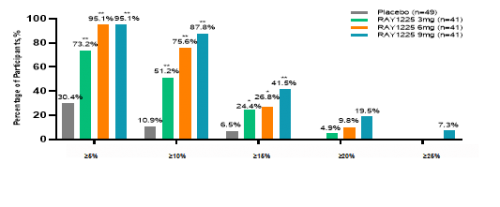
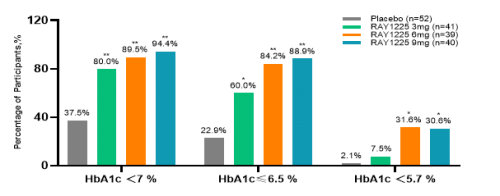
从有效性结果来看,在降糖效果上,RAY1225注射液3~9mg每两周1次给药,治疗24周后糖化血红蛋白(HbA1c)较基线变化的最小二乘均数可达-1.68%~-2.16%,显著优于安慰剂组的-0.33%。降糖达标率方面,RAY1225各组HbA1c<7%的达标率均≥80%;9mg组HbA1c<7%、≤6.5%和<5.7%的比例分别可达94.44%、88.89%和30.56%。与SURMOUNT-CN相比,RAY1225在更低剂量下就实现了与替尔泊肽相近甚至更优的降糖效果[2],展现了其在降糖治疗方面的潜力和优势。
在综合代谢改善方面,除了在降糖方面的显著效果外,RAY1225注射液还对心血管代谢指标,如体重、腰围、血压、血脂和肝酶等方面有积极的影响,能够更全面地改善患者的代谢状况,为患者带来更广泛的健康益处。
图5 糖化血红蛋白较基线变化(FAS)
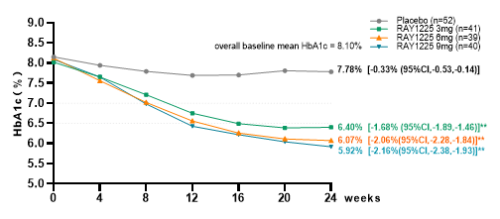
图6 治疗24周降糖达标率(FAS)
就整体结论而言,RAY1225注射液每2周注射一次,连续给药24周给予3~9 mg,在中国成人超重/肥胖参与者,或2型糖尿病参与者安全性、耐受性良好,常见的不良事件与GLP-1类似药似,无新增需特别关注的不良事件,并在这2个中国人群中初步证明了治疗超重/肥胖或2型糖尿病的有效性,且具有剂量相关性。
参考文献:
[1] Zhao L, Cheng Z, Lu Y, et al. Tirzepatide for weight reduction in Chinese adults with obesity: the SURMOUNT-CN randomized clinical trial[J]. JAMA, 2024.
[2] Gao L, Lee B W, Chawla M, et al. Tirzepatide versus insulin glargine as second-line or third-line therapy in type 2 diabetes in the Asia-Pacific region: the SURPASS-AP-Combo trial[J]. Nature Medicine, 2023, 29(6): 1500-1510.
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。














