卫材株式会社宣布,将在6月2日至6日美国伊利诺伊州芝加哥举行的2023年美国临床肿瘤学会(ASCO)年会(#ASCO23)上,展示其各类型肿瘤研发管线的研究进展情况。
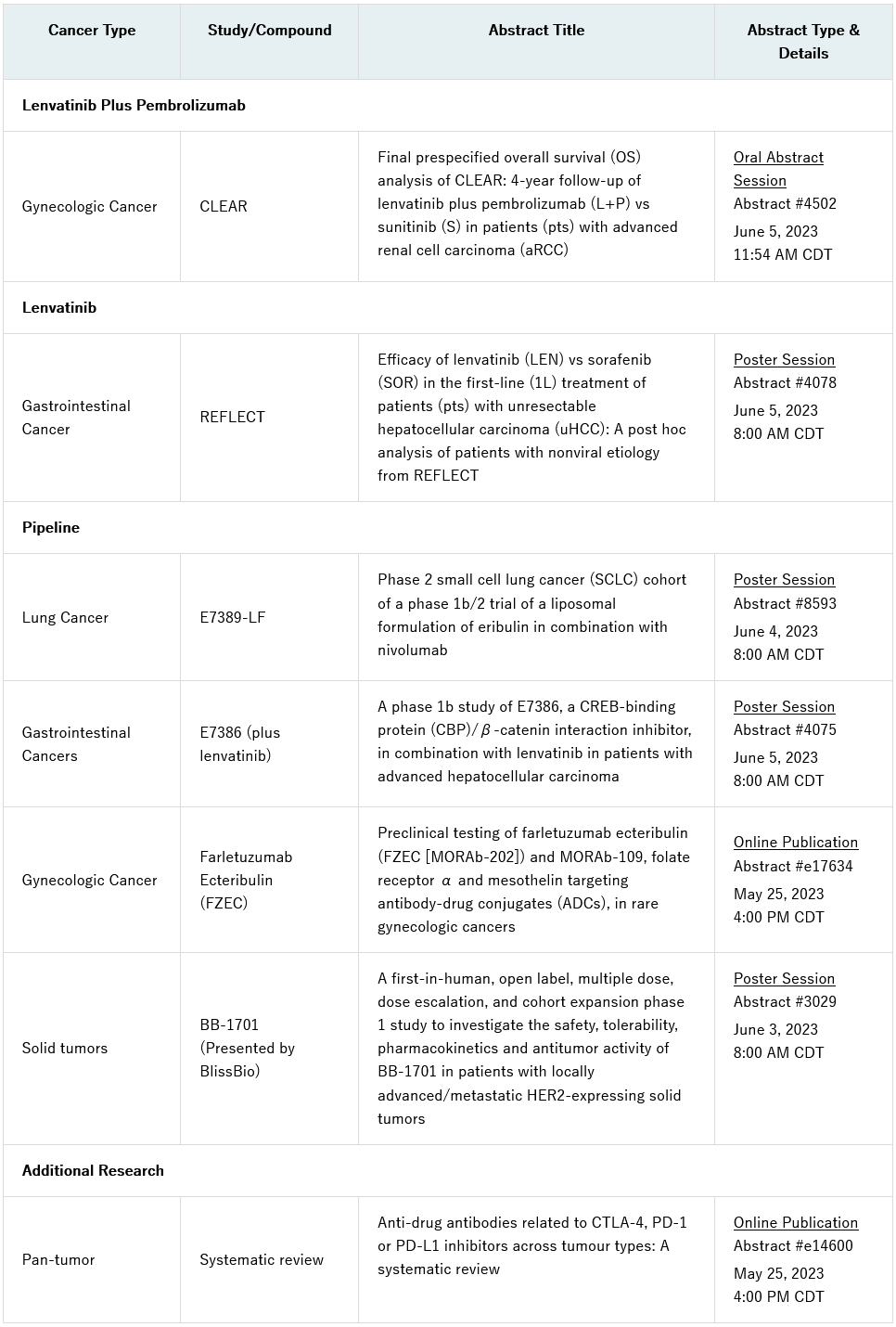
内容包括关键性III期CLEAR(研究307)/KEYNOTE-581试验最终预指定总生存分析结果的口头介绍,该试验评估了仑伐替尼(乐卫玛®,LENVIMA®)加帕博利珠单抗(可瑞达®,KEYTRUDA®)与舒尼替尼用于晚期肾细胞癌患者一线治疗的情况(摘要#4502)。REFLECT试验评估了仑伐替尼单药与索拉非尼一线治疗不可切除的肝细胞癌(HCC)患者的事后分析,也将以海报形式分享(摘要#4078)。
卫材首席科学官、高级副总裁Takashi Owa博士表示,“近年来,晚期肾细胞癌的前景已经发生了变化。在ASCO上,公布关键性CLEAR试验的最终分析结果,代表着我们向患者迈进了一步,并有机会向医生提供更多的长期数据。仑伐替尼和其他肿瘤产品组的最新数据展示了卫材将继续致力于创新和探索新的治疗模式,以实现我们的hhc理念(human health care,关心人类健康),我们的企业使命是满足更多面临癌症诊疗的人们的需求。”
其它研发管线相关内容包括:海报上展示E7386(一种CREB结合蛋白(CBP)/β-catenin相互作用抑制剂)与仑伐替尼联合治疗晚期HCC患者的1b期研究结果(摘要#4075)、E7389-LF(一种艾立布林的新脂质体制剂)与纳武利尤单抗联合使用的1b/II期试验小细胞肺癌队列的评估(摘要#8593)。Farletuzumab ecteribulin (FZEC)(以前称为MORAb- 202)和MORAb-109,抗体药物结合物(ADC)在罕见妇科癌症中的临床前测试的见解也将在网上发表(摘要# e17634)。
此外,Bliss Biopharmaceutical Co. (BlissBio)将在会议上提交一份海报,介绍HER2靶向ADC BB-1701的首次人体研究结果(摘要号3029)。卫材与BlissBio签订了BB-1701的联合开发协议,并在2023年4月获得了战略合作的选择权。目前,BB-1701在美国和中国针对HER2表达的实体瘤的I/II期临床研究正在进行中。
本新闻稿讨论了研究性化合物和FDA已批准产品的研究性用途。并非传达关于疗效和安全性的结论,不保证任何研究性化合物或FDA已批准产品的研究性用途将成功完成临床开发或获得FDA批准。
完整清单如下,这些摘要将于2023年5月25日(星期四)中部夏令时间(CDT)下午4:00公布。
Media Inquiries:
Public Relations Department,
Eisai Co., Ltd.
+81-(0)3-3817-5120













